金属元素和非金属元素是根据什么划分的?
元素不能简单地被分为金属和非金属。 元素周期表中的元素以原子形式存在,由原子核和电子构成。 原子在组合成物质时,其性质与单个原子有显著差异。 因此,应将宏观物质而非原子本身定义为金属或非金属。 独立的原子很难稳定存在,它们在形成物质时性质会改变。
区分金属元素和非金属元素的一个关键指标是它们最外层电子的数量。如果最外层电子数小于四个,通常该元素是金属,尽管存在一些例外,例如氢(H)。 相反,如果最外层电子数大于或等于四个,该元素通常是非金属。
根据最外层电子数。金属的最外层电子数一般是小于4的。非金属最外层电子数是大于4的。当然也有例外,如:氢,最外层电子数是1,但属于非金属。方法三:在同一周期中,金属元素排在前面,非金属元素排在后面。
金属、非金属判断依据:中文字有金字旁的都是金属元素,但是汞也就是水银,它没有金字旁但是是金属元素;按初中来讲就是最外层电子数小于4的都是金属元素,但是有的个别例外比如氢元素(H)最外层是1 具有金属光泽,延展性,导电性等等的就是金属元素;不具有以上特点的就是非金属。
根据元素周期表中的规律首先,金属性由上到下依次增强,非金属性依次减弱。氧族元素,氧是很强的非金属元素,而氧族的钋。则是典型的金属了其次表中元素由左到右金属性依次减弱,非金属性依次增强根据这个规律,碱金属的金属性要强于碱土金属。
主要是元素周期表有条金属和非金属的边界线,是从周期表左上方划到右下方,左边是金属,右边是非金属。
如何根据酸和金属的活动性顺序表判断金属活动性的强弱
起点。拐点。终点。曲线的变化趋势。图象题解题技巧 金属与酸反应的图象(以 Mg、Al、Zn、Fe 与稀盐酸反应为例)。技巧一:当其他条件相同时,金属的活动性越强,产生氢气的速度越快。技巧二:等量金属与足量酸反应(金属耗尽)。
根据金属活动性顺序表判断 金属活动性顺序表中从前到后,金属的活动性逐渐减弱。根据金属与水反应的条件和剧烈程度判断 能与冷水反应的金属的活动性不能与冷水反应能与热水反应的金属的活动性不能与热水反应能与水蒸气反应的金属的活动性。
金属性比较规律:由金属活动性顺序表进行判断。 由元素周期表进行判断,同周期金属性减弱,同主族金属性增强。 由金属阳离子的氧化性强弱判断,一般情况下,氧化性越弱,对应金属性越强,特例,三价铁的氧化性强于二价铜。由置换反应可判断强弱。遵循强制弱的规律。
判断方法如下:由单质与水(或酸)反应转换出氢的难易程度判断,单质与水(或酸)置换出氢越容易,元素的金属性越强。由最高价氧化物的水化物,即氢氧化物的碱性强弱来判断。最高价氢氧化物碱性越强,元素的金属性越强。由金属活动性顺序表进行判断。
一般来说,金属的活动性顺序是由高到低排列的,高活性的金属具有强烈的还原性,常常被用来还原其他的物质,例如,锌可以用来还原铁离子,而低活性的金属则不具备这种能力,它们的化合物也难以通过还原反应来分解。
在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。位于氢前面的金属能置换出盐酸、硫酸中的氢。在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
化学金属性强弱的判断方法
反应活性: 金属单质与水反应的难易程度和剧烈程度,反应越容易,金属性越强。例如,钠与水反应非常剧烈,显示其极强的金属性。 酸反应: 常温下,金属与同浓度酸反应的速度,反应越快,金属性越活跃。钾在酸中的反应速度远超铝,体现了钾的强烈金属性。
依金属活动顺序表判断 金属活动顺序表中,一般位置越后的金属,金属性越弱,原子的还原性越弱。依元素周期表判断 1.同一周期,从左到右:原子的还原性逐渐减弱,氧化性逐渐增强;其对应的离子的氧化性逐渐增强,还原性逐渐减弱。
(1)根据周期表判断,在同一周期中,从左向右金属性逐渐减弱,非金属性逐渐增强;在同一主族中,从上向下,金属性逐渐增强,非金属性逐渐减弱。(2)它的最高价氧化物的水化物的酸性强弱。若该水化物的酸性越强,则元素的非金属性越强;反之,则越弱。
怎么根据元素周期表判断金属性?
根据元素周期表中的规律首先,金属性由上到下依次增强,非金属性依次减弱。氧族元素,氧是很强的非金属元素,而氧族的钋。则是典型的金属了其次表中元素由左到右金属性依次减弱,非金属性依次增强根据这个规律,碱金属的金属性要强于碱土金属。
根据常见金属活动性顺序表判断 金属元素的金属性与金属单质的活动性一般是一致的,即越靠前的金属活动性越强,其金属性越强。。 Na Mg Al Zn Fe 。。
判断方法 由单质与水(或酸)反应转换出氢的难易程度判断,单质与水(或酸)置换出氢越容易,元素的金属性越强。由最高价氧化物的水化物--氢氧化物的碱性强弱来判断。最高价氢氧化物碱性越强,元素的金属性越强。由金属活动性顺序表进行判断。
一 根据元素在周期表中的位置 (1) 同周期元素从左到右,(由于原子半径的减小,原子核对核外电子的吸引力增强,越难失去电子)金属性逐渐减弱。(2) 同主族元素从上到下,(道理同上相反) 金属性逐渐增强。
根据元素周期表和元素周期律判断:同周期元素从左到右金属性逐渐减弱,如第三周期Na﹥Mg﹥Al;同主族元素从上到下金属性增强,如1中所述,Sn和Pb同属Ⅳ主族,Sn在Pb的上方,所以金属性Sn﹥Pb。金属性注意事项 通常当两种不同的金属构成原电池的两极时,一般作负极的金属性较强。
金属性强的元素一般在元素周期表的左下角。在元素周期表中,反映了元素的性质的递变规律。其变化规律如下:同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。
怎样根据原子结构示意图来判断这个原子是否为金属原子
1、一般看它的最外层电子数,金属原子的最外层电子数一般不超过4个,只有几种非金属最外层不超过4个的:氢原子最外层1个电子,氦原子最外层2个电子,硼原子最外层3个电子,碳和硅原子最外层4个电子。
2、根据金属元素的原子结构的特点进行判断,金属元素的原子的最外层电子数一般小于4个,在化学反应中金属元素的原子易失电子。只有几种非金属最外层不超过4个的:氢原子最外层1个电子,氦原子最外层2个电子,硼原子最外层3个电子,碳和硅原子最外层4个电子。
3、原子结构示意图显示,电子在各层中的排列遵循2n的规律,其中n代表电子层数。 在最外层,电子的数量不超过8个,除非是第一层(K层),这种情况下不超过2个。 次外层电子数不超过18个,而倒数第三层电子数不超过32个,这是原子结构的一般规则。
4、原子结构示意图的规律是各电子层最多容纳的电子数目是2n。其次,最外层电子数目不超过8个(K层为最外层时不超过2个)。第三,次外层电子数目不超过18个,倒数第三层电子数目不超过32个。核外电子是分层排列的,从里到外1,2,3,4,5,6,7。
如何区分金属和非金属?
金属与非金属元素的区别主要体现在原子结构、化学性质和物理性质等方面。 原子的最外层电子数:金属元素的原子最外层电子数较少,通常小于4个;而非金属元素的原子最外层电子数较多,一般大于4个。
导电性: 金属通常具有良好的导电性,因为金属中存在自由电子,可以在电场作用下自由移动。因此,如果物质能够导电,有可能是金属。光泽: 金属具有金属光泽,即表面呈现出镜面反射的效果。通过观察物质的外表是否呈现出金属光泽,可以初步判断其是否为金属性物质。
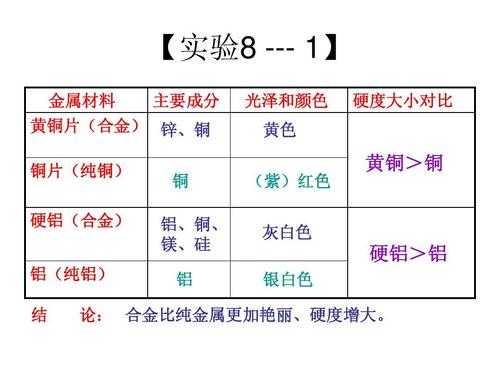
①一般说来金属单质具有金属光泽,大多数金属为银白色;非金属单质一般不具有金属光泽,颜色也是多种多样。②金属除汞在常温时为液态外,其他金属单质常温时都呈固态;非金属单质在常温时多为气态,也有的呈液态或固态。③一般说来,金属的密度较大,熔点较高;而非金属的密度较小,熔点较低。

